Aktuality, z kongresov
Čo by mal vedieť neurológ o anti-CGRP terapii a o bolesti hlavy z nadužívania medikácie

V brnenskom Hoteli Voroněž sa v dňoch 4.‒6. apríla 2019 konalo v poradí X. sympózium o liečbe bolesti hlavy s medzinárodnou účasťou. Záštitu nad konaním odborného stretnutia prevzali MUDr. David Doležil, Ph.D., MBA, predseda Sekcie pre diagnostiku a liečbu bolesti hlavy pri Českej neurologickej spoločnosti ČLS JEP, doc. MUDr. Jiří Kozák, Ph.D., predseda Spoločnosti pre štúdium a liečbu bolesti ČLS JEP, a prof. MUDr. Milan Brázdil, Ph.D., z I. neurologickej kliniky FN u sv. Anny v Brne. V článku prinášame zhrnutie výberu prednášok zo sekcií, venovaných anti-CGRP monoklonálnym protilátkam a ich úlohe v profylaxii migrény a fenoménu medication overuse headache – bolesti hlavy z nadužívania medikácie.
Anti-CGRP protilátky ako nový smer v profylaxii migrény
Príspevok, zameraný na historický kontext ochorenia migrénou, dôležité míľniky v jej liečbe a aj na súčasný stav prezentovala MUDr. Ingrid Niedermayerová z pracoviska Neurologie Brno s.r.o. a z II. neurologickej kliniky FN Brno a LF MU. O výskyte migrény už v dobe neolitu svedčia nálezy lebiek s trepanačnými otvormi. Liečba tohto ochorenia bola však po mnohé stáročia veľmi obmedzená, až koniec 19. storočia priniesol zlom v liečbe migrény a bolesti ako takej. Objav kyseliny acetylsalicylovej a jej zavedenie do lekárskej praxe v roku 1899 pod obchodným názvom Aspirín znamenali veľký posun. V 20. storočí došlo k prudkému rozvoju farmakológie a oblasti výskumu a farmaceutického priemyslu.
Aj liečba migrény zaznamenala mimoriadny pokrok a je v tomto období ohraničená dvoma medzníkmi – v roku 1918 objavom ergotamínu a v roku 1988 objavom sumatriptánu. Ergotamín, námelový alkaloid, je neselektívny agonista serotonínových 5‑HT receptorov. V priebehu ďalších rokov boli syntetizované deriváty námelových alkaloidov – dihydroergotamín v roku 1945, methysergid bol v klinickej praxi po prvý raz popísaný v roku 1959. Významným patofyziologickým objavom bolo objasnenie fyziologickej funkcie serotonínu v roku 1952. Serotonín je považovaný za prozápalový a vazodilatačný neuromediátor, ktorý sa významne uplatňuje v neurogénnom zápale. V nadväznosti na tieto objavy boli syntetizované antiserotonínové liečivá, ktoré našli využitie v profylaxii migrény.
Významný pokrok predstavuje objav a identifikácia jednotlivých subtypov serotonínových receptorov. Celkovo rozlišujeme sedem skupín 5‑HT receptorov, jednotlivé skupiny sa líšia svojou účinnosťou a možnosťou terapeutického využitia. Pre patofyziológiu a liečbu migrény sú dôležité serotonínové receptory 5‑HT1 a ich subtypy. Triptány predstavujú silné a selektívne agonisty receptorov 5‑HT1B/1D. Aktiváciou receptorov 5‑HT1B dochádza k priamej vazokonstrikcii, aktiváciou presynaptických receptorov 5‑HT1D k inhibícii uvoľnenia neuropeptidov a k blokovaniu vazodilatácie a neurogénneho zápalu. Triptány zasahujú do dráhy bolesti a potláčajú jej prenos. Najrozšírenejším liečivom v klinickej praxi a zlatým štandardom je sumatriptán.
Pre liečbu akútneho záchvatu migrény sú teda k dispozícii špecifické liečivá, ale pre profylaxiu migrény sa doteraz používali liekové skupiny, ktoré neboli primárne vyvinuté na liečbu migrény [1,2]. Ďalšie možnosti liečby u chronickej migrény predstavujú od roku 2010 aplikácia botulotoxínu a od roku 2011 stimulácia okcipitálneho nervu. Koniec osmdesiatych rokov 20. storočia bol prelomový popísaním úlohy peptidu CGRP (calcitonin gene‑related peptide) v patofyziológii migrény. Neuropeptid CGRP je tvorený 37 aminokyselinami a je široko exprimovaný v centrálnej i periférnej nervovej sústave. Aktiváciou nociceptorov trigeminovaskulárneho systému dochádza k uvoľneniu CGRP. Sérová koncentrácia CGRP pri záchvate migrény stúpa, a bolo dokázané, že infúzne podanie CGRP provokuje záchvat migrény. Selektívne antagonisty CGRP tak efektívne pôsobia proti jeho účinkom. V roku 2004 boli zverejnené výsledky klinického hodnotenia s prvým antagonistom receptorov pre CGRP (BIBN 4096 BS), ktorý preukázal efekt v akútnej liečbe migrény [3], v roku 2008 bol dokázaný modulačný efekt CGRP na periakveduktálnu šedú kôru u pacientov s migrénou.
Účinnosť a dobrá znášanlivosť anti-CGRP monoklonálnych protilátok v profylaktickej liečbe chronickej aj epizodickej migrény bola opakovane potvrdená ďalšími klinickými hodnoteniami [4]. Tieto účinné látky treba podávať parenterálne, pôsobia s vysokou špecificitou, prestup cez hematoencefalickú bariéru je nepravdepodobný. Ide o veľké molekuly, ktorých biologický polčas sa pohybuje medzi 3–6 týždňami. Rozlišujeme anti-CGRP protilátky, ktoré sa viažu na receptor pre CGRP (erenumab) a súťažia o toto väzbové miesto s CGRP, a ďalej protilátky, viažuce sa priamo na ligand CGRP, ktorému znemožňujú biologickú aktivitu (fremanezumab, galkanezumab, eptinezumab). Od decembra 2018 je v Českej republike dostupná prvá monoklonálna protilátka proti receptoru pre CGRP erenumab. Ide o prvú cielenú profylaktickú liečbu, zasahujúcu do patogenézy migrény.
S novým prístupom v profylaktickej liečbe migrény oboznámil poslucháčov MUDr. Tomáš Nežádal, Ph.D., z Neurologického oddelenia Ústrednej vojenskej nemocnice – Vojenskej fakultnej nemocnice a z Inštitútu neuropsychiatrickej starostlivosti v Prahe. U migrény je dôležité rozlišovať liečbu akútnu a profylaktickú. Profylaktická liečba migrény je indikovaná u pacientov, trpiacich tri a viac dní v mesiaci na stredne ťažkú a ťažkú migrénu, ktorá spôsobuje funkčné obmedzenie, a pravidelne nereaguje na akútnu liečbu. Ďalej u pacientov s bolesťou hlavy, trvajúcou najmenej 6–8 dní v mesiaci, kde je akútna liečba neúčinná; pri kontraindikácii akútnej liečby; u pacientov s ťažkými neurologickými príznakmi aj u menej častých atakov (migréna s kmeňovými príznakmi, hemiplegická migréna); u pacientov trpiacich na migrénu, ktorá napriek dôslednému dodržiavaniu režimu, vylúčeniu spúšťacích faktorov aj akútnej liečbe významne ovplyvňuje kvalitu života. Profylaktická liečba je indikovaná aj u pacientov s vysokým rizikom vzniku bolesti hlavy z nadužívania medikácie, tzv. medication overuse headache (MOH).
Akútnu medikáciu (nesteroidné antiflogistiká, triptány) užíva 98 % pacientov [5], profylakticky je liečených približne 12 % pacientov (pomer žien a mužov 2 : 1), avšak perzistencia na terapii je veľmi nízka – 25 % po šiestich mesiacoch a 14 % po 12 mesiacoch.
Podkladom racionálnej profylaktickej liečby sú svetové odporúčania (guidelines). Z účinnosti týchto liečiv vychádza aj definícia farmakorezistentnej migrény. Môže ísť o epizodickú migrénu s častejšími záchvatmi (4–14/mesiac), chronickú migrénu (≥ 15/mesiac) alebo o migrénu v kombinácii s MOH, keď došlo ku zlyhaniu najmenej dvoch profylaktík s rôznym mechanizmom účinku a s preukázaným efektom. Profylaktikum by malo byť podávané v dostatočnej dávke (podľa tolerancie pacienta) a po dostatočne dlhý čas (aspoň tri mesiace).
Ďalšiu možnosť liečby potom predstavujú na prvom mieste práve anti‑CGRP protilátky, u ktorých je však na základe výsledkov doterajších klinických hodnotení ešte potrebné jednoznačne doriešiť dĺžku trvania liečby. Boli vypracované americké a európske štandardy [6,7], podľa ktorých by mal pacient anti‑CGRP liečbu dostávať minimálne tri, ale radšej šesť mesiacov. Ďalej treba zhodnotiť účinnosť liečby. Podľa amerických odporúčaní by sa mal priemerný počet migrenóznych dní za mesiac (monthly migraine days, MMD) znížiť minimálne o 50 % a ku klinicky významnému zlepšeniu by malo dôjsť v niektorom z validovaných pre migrénu špecifických dotazníkov (napr. Migraine Disability Assessment Test, Migraine‑Specific Quality of Life Questionnaire, Headache Impact Test, Patient‑Reported Outcome Measurement Information System). Európske smernice sú podobné, zhodnotenie efektu a prípadné ukončenie liečby pri jej neúspechu sa odporúča po 6–12 mesiacoch podávania. Oproti pacientom, trpiacim na epizodickú migrénu, je možné u pacientov s chronickou medikáciou ponechať profylaktickú liečbu. Anti‑CGRP liečba by nemala byť podávaná tehotným, dojčiacim pacientkám, osobám s abúzom alkoholu a drog, chorým so závažným kardiovaskulárnym a cerebrovaskulárnym ochorením a s ťažkou mentálnou poruchou.
Monoklonálne protilátky v liečbe migrény
Témou monoklonálnych protilátok všeobecne otvoril ďalší blok profesor MUDr. Vojtěch Thon, Ph.D., z centra RECETOX Masarykovej univerzity a AKIMED v Brne. Prednášajúci najprv vysvetlil rozdiel medzi imunoglobulínmi a protilátkami ‒ protilátka je vždy špecifická a konkrétna, imunoglobulíny zas predstavujú všetky protilátky, ktoré sme dokázali vytvoriť v priebehu života. V prípade protilátky v triede IgG ide o dvojväzbovú molekulu, u ktorej rozlišujeme tzv. F(ab)2 väzbovú časť a Fc časť, ktorá má ďalšie vlastnosti (napr. viaže komplement) [8]. V biologickej liečbe je pre nás najvýznamnejší proces vyviazania a blokovanie cieľovej molekuly danou konkrétnou protilátkou.
Bunkou špecifickej imunitnej odpovede, ktorá produkuje protilátky, je B lymfocyt. B lymfocyt nesie svoj špecifický receptor, ktorým je molekula protilátky. Rozlišujeme protilátky monoklonálne, ktoré pochádzajú z jedného klonu B lymfocytov a majú práve jednu konkrétnu špecifičnosť, a protilátky polyklonálne, ktoré vznikajú napr. po vakcinácii či po prekonanej infekcii. Päťdesiate roky minulého storočia priniesli možnosť substitúcie protilátok u pacientov, ktorí trpia na ich deficit, zároveň však otvorili problematiku bezpečnosti podávania imunoglobulínov, predovšetkým ich subkutánnu a intravenóznu aplikáciu. Imunoglobulíny sa podávajú len v substitučných dávkach 400 mg/kg/3‒4 týždne (to znamená približne 30 g látky u 70 kg pacienta). V Českej republike sa tieto relatívne vysoké dávky imunoglobulínov subkutánne aplikujú prostredníctvom pumpy, čím sa redukuje výskyt nežiaducich účinkov, a podanie je teda napriek zvýšenému dávkovaniu bezpečné (deti 5‒10 ml, dospelí 10‒15 ml s.c. do jedného miesta vpichu). Ďalej je k dispozícii tzv. rapid push terapia, s pumpou alebo bez pumpy, ktorá umožňuje aj kratšie intervaly podávania.
Monoklonálne protilátky stoja v centre záujmu biologickej liečby, lebo sú namierené proti konkrétnemu receptoru a dá sa tak využiť ich neutralizačný, ako aj blokujúci efekt. Pôvodne boli monoklonálne protilátky myšie, génová technológia umožnila vývoj protilátok humanizovaných a humánnych, vďaka ktorým sa dá znížiť výskyt nežiaducich účinkov. V nomenklatúre rozlišujeme protilátky myšie (prípona -omab), chimérické (-ximab), humanizované (-zumab) a humánne (-umab) [9‒11], tabuľka 1.
Tab. 1 Vývoj monoklonálnych protilátok
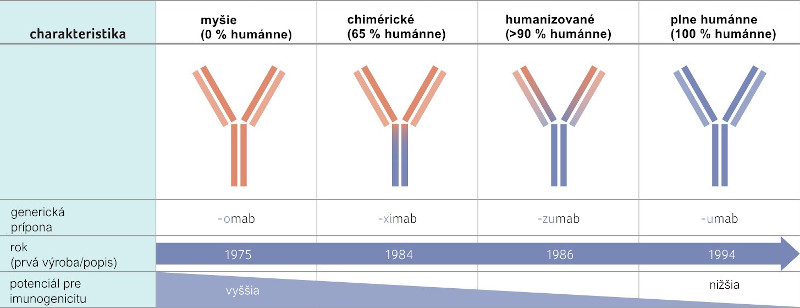
Podľa [10,11] – Foltz, et al., 2013; Beck, et al., 2010
MUDr. Rudolf Kotas, Ph.D. z Neurologickej kliniky LF UK a FN Plzeň sa zameral na mechanizmus vzniku migrény. Podstatou bolesti hlavy je stimulácia nociceptívnych trigeminových vlákien, ktoré patria k tzv. trigeminovaskulárnemu systému. Pri stimulácii sa z perivaskulárnych nervových zakončení uvoľňujú neurotransmitery, predovšetkým CGRP, v menšej miere potom substancia P a neurokinín A. Uvedeným spôsobom dochádza k vazodilatácii meningeálnych ciev a vzniká sterilný perivaskulárny zápal. Stimulácia, vazodilatácia a zápal sú zodpovedné za bolesť hlavy u migrény. Vazoaktívne neurotransmitery a najmä CGRP vedú k uvoľneniu zápalových mediátorov (serotonín, histamín, prostaglandíny a leukotriény) z aktivovaných a degranulovaných durálnych mastocytov. Mastocyty sa nachádzajú v blízkosti krvných ciev a majú úzky kontakt so zakončeniami nociceptívnych neurónov. Najviac poznatkov máme o úlohe serotonínu – môže sa viazať na serotonínové receptory 5-HT2, ktoré sa nachádzajú na endoteliálnych bunkách intrakraniálnych krvných ciev. Tieto receptory majú vazodilatačnú a prozápalovú schopnosť, pretože vyvolávajú tvorbu oxidu dusnatého a podieľajú sa tak na rozvoji migrény. Opačne pôsobia receptory 5-HT1B, lokalizované rovnako v stene intrakraniálnych ciev. Ich aktivácia vyvoláva vazokonstrikciu, sú teda schopné rušiť vplyv receptorov 5-HT2. Agonisty receptorov 5HT1D, lokalizovaných na trigeminových nervových zakončeniach, dokážu po naviazaní na receptor zabrániť uvoľneniu CGRP a ďalších neurotransmiterov, čím zabraňujú vzniku perivaskulárneho sterilného zápalu. To sa využíva v liečbe na potlačenie bolesti – u triptánov, ktoré predstavujú špecifické lieky na zvládnutie ataku bolesti hlavy.
Pre uvoľnenie neurotransmiterov má význam aktivácia niektorých typov tzv. TRP (transient receptor potential) kanálov, ktoré sú prítomné na nociceptívnych nervových vláknach a okrem iného sa uplatňujú pri percepcii bolesti. Z hľadiska migrény sú najzaujímavejšie vaniloidné TRPV1 a ankyrínové TRPA1 kanály, ktorých aktivácia podnecuje uvoľnenie CGRP a ďalších neurotransmiterov, ako aj rozvoj sterilného zápalu. U migrény s aurou zapríčiňuje aktiváciu TRP kanálov najskôr elektrická porucha mozgovej kôry, nazývanej kortikálne sa šíriaca depresia (cortical spreading depression, CSD) elektrickej aktivity, ktorá začína v okcipitálnej kôre, vyznačuje sa koncentrickou vlnou depolarizácie neurónov a pomaly postupuje po mozgovej kôre dopredu. Je nasledovaná prechodnou hypofunkciou neurónov, spôsobenou zastavením všetkej ich synaptickej aktivity. Kortikálne sa šíriaca depresia je zodpovedná za klinické príznaky aury a je sprevádzaná význačnými zmenami krvného prietoku – na začiatku v mieste, kde dochádza k depolarizácii neurónov, kortikálny krvný prietok najprv stúpa, v oblasti s hypofunkciou neurónov klesá. Podobné zmeny prietoku sa dajú pozorovať u pacientov s migrénou s atakami indukovanými arteriografiou alebo u spontánnych atakov pomocou metódy SPECT. U migrény bez aury svedčia niektoré nálezy na PET pre obdobnú poruchu, ako je CSD, ale bez klinického korelátu. TRP kanály môžu byť aktivované aj priamo niektorými exogénnymi činiteľmi, napr. etanolom v alkoholických nápojoch (TRPV1) alebo komponentami cigaretového dymu (TPRA1).
Calcitonin gene-related peptide je kľúčovým neuropeptidom v patogenéze migrény. Jeho koncentrácia je u pacientov v krvi zvýšená počas atakov migrény. Sumatriptán, ktorý sa používa pri migréne, hodnotu CGRP normalizuje. Intravenózna injekcia CGRP vyvoláva migrenóznu bolesť hlavy u pacientov s migrénou, nie však u kontrolných jedincov. Na základe týchto poznatkov boli vyvinuté monoklonálne protilátky proti CGRP alebo proti jeho receptoru, ktoré budú v blízkej budúcnosti znamenať kvalitatívny skok v liečbe migrény.
Ako posledný prednášajúci vystúpil MUDr. David Doležil, Ph.D., MBA, z Headache Centrum Praha, Mestskej polikliniky Praha. V úvode svojej prednášky zhrnul povedané, a potom sa venoval predovšetkým výsledkom klinických hodnotení s anti-CGRP monoklonálnymi protilátkami. Tri z týchto protilátok už majú svoj obchodný názov a ich podávanie je schválené v ČR (erenumab, Aimovig; fremanezumab, Ajovy; galkanezumab, Emgality), v skutočnosti je však zatiaľ k dispozícii len erenumab. Doktor Doležil poukázal na niektoré rozdiely medzi uvedenými látkami, ktorých zhrnutie je uvedené v tabuľke 2.
Tab. 2 Monoklonálne protilátky v profylaxii migrény
|
protilátka |
erenumab |
galkanezumab |
fremanezumab |
eptinezumab |
|---|---|---|---|---|
|
typ |
humánna |
humanizovaná |
humanizovaná |
humanizovaná |
|
podtrieda IgG |
2 |
4 |
2a |
1 |
|
cieľ |
receptor CGRP |
CGRP |
CGRP |
CGRP |
|
biologická dostupnosť (%) |
40‒74 |
40 |
? |
100 |
|
biologický polčas (dni) |
21 |
25‒30 |
45 |
28 |
|
spôsob podania |
s.c./mesačne |
s.c./mesačne |
s.c./mesačne alebo kvartálne |
i.v. kvartálne |
CGRP – calcitonin gene-related peptide; IgG – imunoglobulín G; i.v. – intravenózne; s.c. – subkutánne
Erenumab (plne humánna protilátka IgG2 namierená proti receptoru CGRP) bol spočiatku testovaný v dávkach 7 mg, 21 mg a 70 mg, menšie dávky neboli účinné, preto sa následne testovalo 70 mg a 140 mg. Vo všetkých štúdiách boli primárnym cieľovým ukazovateľom MMD a ich redukcia k určitému dátumu, prípadne podiel pacientov, ktorí majú viac ako 50 % migrenóznych dní za mesiac. V rámci sledovania bezpečnosti neboli pozorované žiadne závažné nežiaduce účinky ani laboratórne a EKG abnormality. Tieto predbežné výsledky boli potvrdené v ďalších štúdiách fázy III. V štúdii ARISE, ktorá porovnávala dávku 70 mg erenumabu oproti placebu po dobu troch mesiacov, bolo zaradených celkom 577 dospelých. Signifikantná redukcia MMD bola potvrdená v skupine s erenumabom v priebehu 9.‒12. týždňa. Medzi najčastejšie nežiaduce účinky patrila obstipácia (u 2 % pacientov).
Dôležitým faktorom novej liečby anti-CGRP monoklonálnymi protilátkami je skutočnosť, že táto liečba vykazuje efekt u pacientov, u ktorých už predtým zlyhali iné profylaktické postupy. Túto skutočnosť potvrdila napr. štúdia fázy III STRIVE. Efektivita a bezpečnosť erenumabu u pacientov s chronickou migrénou bola najprv hodnotená v multicentrickej, placebom kontrolovanej, randomizovanej štúdii fázy II [8]. Bolo do nej zaradených celkovo 667 subjektov vo veku 18‒65 rokov do ramien so 70 mg a so 140 mg erenumabu a s placebom. Štúdia trvala 12 týždňov a erenumab bol aplikovaný raz mesačne subkutánne. Signifikantná redukcia MMD oproti placebu bola preukázaná v oboch skupinách s erenumabom, o niečo lepšie parametre boli doložené pre dávku 140 mg.
Fremanezumab (plne humanizovaná protilátka IgG2a s väzbou na CGRP) bol hodnotený v štúdii fázy III HALO (na základe výsledkov štúdií fázy II podobne ako u ostatných anti-CGRP monoklonálnych protilátok) u pacientov s chronickou migrénou. Bolo randomizovaných celkovo 1 130 dospelých. Pacienti boli rozdelení do troch ramien v pomere 1 : 1 : 1 so subkutánnym podaním študijnej látky raz mesačne. V prvom ramene bol ako prvá dávka podávaný fremanezumab 675 mg, ako druhá a tretia dávka placebo. V druhom ramene pacienti dostávali 675 mg fremanezumabu v prvej dávke, 225 mg v druhej a tretej dávke každé štyri týždne; tretie rameno bolo placebové. Obe aktívne skupiny vykázali štatisticky významné zlepšenie vo všetkých sledovaných parametroch. Podiel pacientov s minimálne 50 % redukciou MMD predstavoval v ramene s dávkou 675 mg kvartálne 38 %, v ramene s mesačnou dávkou fremanezumabu 41 % a len 18 % v placebovej skupine. V štúdii HALO EM v indikácii prevencie epizodickej migrény bolo zaradených 875 pacientov do troch ramien v pomere 1 : 1 : 1. V prvom ramene užívali 225 mg fremanezumabu subkutánne raz mesačne, v druhom ramene 675 mg v prvej dávke, druhý a tretí mesiac placebo, v treťom ramene placebo. Redukcia MMD predstavovala pokles z 8,9 na 4,6 dňa v ramene s mesačným podaním, z 9,2 na 4,9 dňa v ramene s kvartálnym podaním, z 9,1 na 5,9 dňa u placeba. Podiel pacientov s viac ako 50 % redukciou MMD v priebehu 12 týždňového liečebného obdobia bol 47,7 % v ramene s mesačným podaním fremanezumabu, 44,4 % u vysokodávkovaného kvartálneho fremanezumabu.
Galkazenumab (plne humanizovaná protilátka IgG4 cielene mierená na CGRP ligand) bol hodnotený v štúdii fázy III EVOLVE-1, kam bolo randomizovaných 1 671 dospelých s epizodickou migrénou do troch ramien v pomere 2 : 1 : 1 s mesačným subkutánnym podaním študijnej látky v dávke 120 mg, 240 mg a s placebom. Predchádzajúca preventívna liečba migrény predstavovala vylučovacie kritérium pre zaradenie. Obe ramená s aktívnou látkou preukázali signifikantné zlepšenie, redukciu MMD počas šiestich mesiacov trvania štúdie – 4,6 dňa, 4,7 dňa ‒ v porovnaní s placebovým ramenom (2,8 dňa). U významne vyššieho počtu pacientov v oboch ramenách s galkanezumabom bola zaznamenaná redukcia MMD o 50 %, 75 % a 100 % v porovnaní s placebom. Podobné výsledky sa dosiahli aj v štúdii EVOLVE-2. V dvojito zaslepenej, randomizovanej, placebom kontrolovanej štúdii fázy III REGAIN u pacientov s chronickou migrénou bolo randomizovaných 1 113 dospelých do troch ramien v pomere 2 : 1 : 1 s mesačne subkutánne podávaným galkanezumabom v dávke 120 mg, 240 mg a s placebom. Východisková hodnota MMD bola rovnaká naprieč všetkými skupinami (19,4 dňa). Obe ramená s galkanezumabom vykázali počas trojmesačného liečebného obdobia signifikantné zlepšenie.
Eptinezumab (humanizovaná protilátka IgG1, ktorá sa selektívne viaže k obom izoformám CGRP – alfa, beta) bol testovaný v štúdii fázy III PROMIS 1 s 888 dospelými pacientami, ktorí boli zaradení do placebového ramena a do ramien s liečbou 30 mg, 100 mg a 300 mg eptinezumabu, podávanými intravenózne každých 12 týždňov. Hodnota MMD pred zahájením terapie predstavovala 8,5 dňa. Po dvoch infúziách eptinezumabu 300 mg podávaných po 12 týždňoch sa podiel pacientov s viac ako 50 % redukciou MMD zvýšil z 56,3 % v týždňoch 1‒4 na 63,1 % v týždňoch 21‒24 a podiel pacientov s viac ako 75 % redukciou MMD stúpol z 31,3 % na 40,5 % (300 mg) v porovnaní s placebom (z 20,3 % na 32,4 %). V prípade 100 % redukcie išlo o nárast zo 14,9 % na 23,4 %, resp. z 5,9 % na 14,4 %. V štúdii PROMIS 2 bolo randomizovaných 1 072 pacientov do ramien s 300 mg alebo so 100 mg eptinezumabu alebo s placebom. Eptinezumab bol podávaný intravenózne raz za 12 týždňov. Primárnym cieľovým ukazovateľom bola priemerná zmena MMD pred liečbou a v 12. týždni liečby. Pacienti v oboch aktívnych ramenách dosiahli signifikantné zlepšenie oproti placebu.
Medication overuse headache
Tému MOH otvorila svojou prednáškou opäť MUDr. Ingrid Niedermayerová. Z praktického pohľadu ide o pomerne komplikovanú diagnózu, združujúcu neurologické a psychiatrické ochorenie, ktorej výskyt v populácii je veľmi častý. To doložili výsledky štúdie z roku 2015 [12], ktorá po obdobie 25 rokov monitorovala 310 vybraných diagnóz, z ktorých MOH obsadila v miere výskytu dvadsiate miesto.
Bolesti hlavy z nadužívania medikácie sa dajú definovať ako bolesti migrenózneho, tenzného alebo zmiešaného typu, ktoré sa objavujú 15 a viac dní v mesiaci, a nadužívanie liečby musí trvať tri a viac mesiacov. Ďalšie podskupiny sa potom rozlišujú podľa typu nadužívanej medikácie. Podľa tretieho vydania Medzinárodnej klasifikácie bolestí hlavy (International Headache Society, ICHD-III, 2018) [13] sa MOH zaraďuje do skupiny 8.2 a u daných pacientov je ešte klasifikovaná pôvodná bolesť hlavy. Najčastejšie sa MOH združuje s chronickou migrénou, ďalej s chronickým tenzným typom bolesti hlavy, prípadne s inými primárnymi alebo sekundárnymi bolesťami hlavy. Ochorenie pravdepodobne predstavuje syndróm, ktorý sa prekrýva. Medication overuse headache má rôzne fenotypy, bolesť sa rozvíja s novými charakteristikami, ktorými sú napríklad zmena jej kvality, zmena v temporálnom vzorci bolesti alebo premena v pridružených príznakoch. Pacienti ďalej môžu trpieť na zvyšujúcu sa frekvenciu atakov, a tieto ataky môžu byť ťažšie. V prípade klasifikácie jednotlivých podtypov bolesti podľa nadužívanej látky predstavuje dôležité kritérium počet dní, po ktorý chorý liek užíva. Pokiaľ pacient užíva jednozložkové analgetiká (paracetamol, metamizol) alebo nesteroidné antireumatiká (NSA), o nadužívaní sa hovorí v prípade ak sa užívajú tieto lieky 15 a viac dní v mesiaci. Ak užíva kombinované analgetiká, triptány, opioidy, ergotamín alebo kombináciu uvedených látok, stačí na označenie nadužívania už 10 a viac dní v mesiaci (2‒3 dni v týždni).
V posledných 20 rokoch došlo ku zmene typu nadužívaných látok. V minulosti bol touto látkou predovšetkým ergotamín, resp. prípravky, kombinované s ergotamínom či ergotamínové čapíky, v poslednom desaťročí sú to triptány. V prípade jednozložkových a kombinovaných analgetík je nadužívanie zaznamenané v 50 percentách a viac, opioidy sú u nás nadužívané menej ako napr. v USA. Prevalencia uvedeného typu bolesti hlavy sa uvádza u približne 2 % populácie, pričom ženy sú postihnuté trikrát častejšie ako muži. Typického pacienta s MOH predstavuje žena v strednom veku (menej postihuje deti, adolescentov a seniorov), často s nižším sociálne ekonomickým statusom a s vyšším BMI (body mass index). Nezriedka sú pacienti postihnutí aj psychiatrickými chorobami, ako sú depresie, úzkostné stavy a poruchy spánku.
Pri hodnotení rizikových faktorov treba klásť dôraz na rodinnú a osobnú anamnézu, aby lekár zistil, ktoré potenciálne psychopatologické javy sa v rodine vyskytli (alkoholizmus, samovražda, psychiatrická choroba a i.). Čo sa týka osobnej anamnézy, pacienti s MOH nezriedka popisujú emočné strádanie v detstve, týranie či sexuálne zneužívanie, často je súčasťou anamnézy rozchod rodičov. Práve stresové situácie, chronický stres či trauma môžu významne ovplyvniť hypotalamo-hypofyzárnu adrenergickú os. Výsledkom je narušenie odpovede na stres a dysregulácia tejto osi môže viesť k rozvoju chronickej bolesti, prípadne chronickej migrény. Rovnako aj dĺžka ochorenia je rizikovým faktorom, pretože v určitých situáciách dochádza u pacientov k nárastu početnosti a intenzity atakov. Pokiaľ nie sú tieto problémy dostatočne liečené, môže choroba prejsť do chronickej fázy. Medzi protektívne faktory vzniku týchto postihnutí patrí zahájenie profylaktickej liečby, vyššie dosiahnuté vzdelanie pacienta, život v partnerskom zväzku, fyzická aktivita a cvičenie, ako aj manažment stresu.
Vo vzťahu medzi bolesťou hlavy a užívaním liekov existuje priamo úmerný vzťah. Bolesť vedie pacienta k tomu, aby užil liek, pokiaľ sa bolesť hlavy zvyšuje, alebo sú ataky početnejšie, narastá aj frekvencia použitia medikácie V tomto procese môže nastať niekoľko typov situácií: 1) nadužívanie medikácie je jednoduchou reakciou na zvyšujúcu sa frekvenciu atakov, 2) ukončenie alebo prerušenie užívania lieku môže byť spúšťačom návratu bolesti, 3) zvýšené užívanie akútnej medikácie môže spôsobiť MOH sekundárne de novo, 4) alebo sa môže uplatniť až spätná väzba, keď nárast bolesti hlavy vedie k eskalácii dávok akútnej medikácie. Z tohto hľadiska je dôležitý poznatok, či je rozdiel medzi jednotlivými liekmi, ktoré pacient užíva za účelom zvládnutia akútneho záchvatu, a či existuje určité riziko prechodu od epizodickej migrény k migréne chronickej. Štúdia z roku 2008 porovnávala referenčný paracetamol s NSA, barbiturátmi, triptánmi a opioidmi. Jednoznačne rizikovými sa v tomto hodnotení ukázali byť barbituráty a opioidy; triptány a NSA boli potom ambivalentne rizikové oproti paracetamolu [14].
Medication overuse headache znamená pre pacientov rovnako aj výraznú zmenu kvality života v porovnaní s chorými, ktorí trpia len na migrénu. Táto kvalita je hodnotená pomocou osempoložkového dotazníka Quality of Life Svetovej zdravotníckej organizácie (WHO), podľa ktorého je pacient, trpiaci na MOH, významne znevýhodnený až v šiestich položkách.
Na riešenie problematiky MOH v klinickej praxi sa zamerala primárka MUDr. Jolana Marková z Neurologickej kliniky 3. LF UK a Thomayerovej nemocnice v Prahe. Prednášajúca zdôraznila v nadväznosti na predchádzajúci príspevok aj význam podrobnej farmakologickej anamnézy. S pacientom treba prebrať účinnosť jeho bývalej medikácie, mieru úľavy od bolestí a obdobie, po ktoré úľava trvala. Zásadné je vysvetliť pacientovi súvislosť medzi bolesťou hlavy a nadužívaním analgetík a ako jedinú cestu ku zlepšeniu nutnosť pozvoľného alebo náhleho ukončenia nadužívania medikácie.
Primárka Marková ďalej popísala postup riešenia, pokiaľ sa pacient sám rozhodne ukončiť nadužívanie medikácie (obr. 1). Pacientom je najprv ponúknutá krátkodobá hospitalizácia (zvyčajne stačí 4–5 dní), keď prebehne detoxikácia. Približne 80 % pacientov má pocit, že situáciu nezvládnu sami. Hospitalizácia im umožní prekonať abstinenčné príznaky (ako je nárast bolesti hlavy, nauzea, nepokoj, nespavosť), farmakoterapia sa podáva infúzne a volí sa podľa typu nadužívanej medikácie, jej množstva, ako aj podľa symptomatológie. Dôležité je, aby chorý nemal po prepustení nadužívané lieky doma. S výhľadom do budúcnosti je tiež potrebné nastaviť analgetickú medikáciu pre zvládnutie bolestí hlavy a zvoliť iné analgetiká, ako boli nadužívané. Prednášajúca upozornila, že opioidy nevolíme nikdy, z hľadiska nadužívania sú veľmi rizikové. Po odznení abstinenčných príznakov sa zahajuje profylaktická liečba, s výhodou sa tu dá uskutočniť psychologické vyšetrenie, ktoré nás nasmeruje, či zvoliť skôr liek zo skupiny antidepresív, antiepileptík, alebo betablokátorov či blokátorov kalciových kanálov. Opäť podľa dohovoru s pacientom a jeho preferenciou. Dôležité je upozorniť chorého, že efekt liečby môžeme odsledovať nie skôr ako za šesť týždňov, počas prvých 14 dní je možné zaznamenať len to, či pacient liečbu toleruje, účinnosť zvyčajne hodnotíme po troch mesiacoch podávania.
Postup odstránenia bolesti hlavy z nadužívania medikácie
- Edukácia pacienta
- Náhle alebo postupné ukončenie liečby
- Úľava od abstinenčných príznakov
- Zavedenie novej liečby
- Sledovanie a opätovné zhodnotenie bolestí hlavy
- Prevencia relapsov
Podmienkou úspechu detoxikácie je spolupráca a dôvera pacienta. Dlhodobejšie sledovanie pacientov ukazuje, že náhle odňatie nadužívanej medikácie má vyššiu úspešnosť. Pri pozvoľnom vysadzovaní hrozí vyššie riziko recidív napr. pri strese. Pokiaľ pacient vydrží bez nadužívanej medikácie 4–8 týždňov (podľa typu lieku a dĺžky nadužívania), začne sa situácia zlepšovať a bolesť ustúpi. Vhodná je po prepustení z hospitalizácie ešte pracovná neschopnosť v trvaní 2–3 týždňov. Prednášajúca kládla veľký dôraz na vedenie diára, kde je možné sledovať spätnú väzbu.
Po odňatí nadužívanej medikácie sa stav väčšiny chorých zlepší a upraví sa aj odozva na profylaktickú liečbu. Celkom zásadná je prevencia MOH a oboznámenie pacienta s možnými rizikami.
Redakčne spracovali PharmDr. Kateřina Viktorová, PhDr. Nikola Homolová Richtrová
Literatúra

