Aktuality
Účinnost a bezpečnost fremanezumabu podávaného měsíčně versus čtvrtletně ve studii z reálného života

Fremanezumab, anti‑CGRP monoklonální protilátka pro preventivní léčbu migrény, je dostupný ve dvou dávkovacích režimech – 225 mg měsíčně a 675 mg čtvrtletně. Předchozí studie prokázaly účinnost a bezpečnost obou režimů, avšak data z reálného života zatím nejsou dostatečná. Cílem italské prospektivní multicentrické studie bylo porovnat účinnost a bezpečnost měsíčně a čtvrtletně podávaného fremanezumabu v tzv. real‑life podmínkách [1].
Úvod
Migréna představuje vysoce invalidizující neurologické onemocnění s globální prevalencí 14–15 %, které postihuje zejména mladé ženy [2]. V roce 2020 vstoupily do preventivní terapie tohoto onemocnění monoklonální protilátky zacílené na calcitonin gene‑related peptide (CGRP) – neuropeptid zapojený do patofyziologie migrény [3].
Fremanezumab je humanizovaná anti‑CGRP monoklonální protilátka, která je pro léčbu migrény schválena ve dvou dávkovacích režimech – subkutánně 225 mg měsíčně a 675 mg čtvrtletně [4]. Účinnost a bezpečnost měsíčně a čtvrtletně podávaného fremanezumabu byly poprvé prokázány ve dvou klíčových randomizovaných, dvojitě zaslepených, placebem kontrolovaných studiích fáze III HALO EM u pacientů s epizodickou migrénou a HALO CM u pacientů s chronickou migrénou [5,6]. Studie FOCUS doložila, že fremanezumab byl účinný po dobu delší než 12 týdnů u pacientů se selháním až čtyř preventivních antimigrenických medikací [7]. Post hoc analýza uvedených tří studií ukázala, že čtvrtletní a měsíční léčba fremanezumabem významně snižuje nejen četnost atak a jejich trvání, ale také závažnost bolestí hlavy u pacientů s epizodickou i chronickou migrénou [8]. Oba dávkovací režimy jsou rovněž účinné při redukci nadměrného užívání akutních léků ve srovnání s placebem [9].
Ačkoliv randomizované kontrolované studie (randomised controlled trials, RCTs) prokázaly dosažení srovnatelných výsledků efektivity a bezpečnosti u obou dávkovacích režimů, nejsou k dispozici studie, které by provedly přímé statistické srovnání mezi dvěma dávkami. Model expoziční odpovědi s využitím údajů z RCTs simuloval srovnání účinnosti mezi těmito dvěma dávkovacími režimy a predikoval dosažení klinického přínosu u obou dávek fremanezumabu v případě epizodické i chronické migrény [10]. Recentní systémový přehled a metaanalýza RCTs doložily, že nejsou žádné významné rozdíly ve snížení frekvence atak migrény mezi měsíčně a čtvrtletně podávaným fremanezumabem [11].
Studie z reálného života potvrdily účinnost a bezpečnost měsíční a čtvrtletní léčby fremanezumabem u chronické i epizodické migrény a také u pacientů s vícenásobnými předchozími selháními medikace a různými komorbiditami [12–16]. Japonská studie porovnávala účinnost měsíčně a čtvrtletně podávaného fremanezumabu a přinesla srovnatelné výsledky za období šesti měsíců, avšak bez hodnocení změn ve výsledcích týkajících se postižení nebo bezpečnosti [16].
Cílem italské studie je určit statisticky významné rozdíly mezi dvěma dávkami fremanezumabu v reálných podmínkách, konkrétně posouzení jejich účinnosti při snižování počtu dnů s migrénou a bolestí hlavy a výzkum potenciálních rozdílů při zmírňování závažnosti záchvatů a disability, redukci spotřeby analgetik a posouzení bezpečnosti.
Metody
Multicentrická prospektivní studie z reálného života zahrnula tři italská centra pro léčbu bolestí hlavy v Miláně, Boloni a Římě [1]. Od února 2020 do dubna 2023 bylo do studie zařazeno celkem 95 pacientů s migrénou. Kritéria pro zařazení byla následující: věk ≥ 18 let, diagnóza migrény dle Mezinárodní klasifikace bolestí hlavy, 3. vydání (ICHD‑3) [17] a způsobilost k léčbě anti‑CGRP monoklonálními protilátkami. Podle aktuálních národních úhradových kritérií je profylaktická léčba fremanezumabem plně hrazena u pacientů s migrénou, kteří mají nejméně osm dní s migrénou v měsíci (monthly migraine days, MMD), středně těžké nebo těžké postižení související s migrénou dle dotazníku Migraine Disability Assessment (MIDAS) a u nichž selhaly alespoň tři třídy preventivních léků, včetně tricyklických antidepresiv, antikonvulziv, betablokátorů a onabotulotoxinu A. Vyřazovacími kritérii byly kardiovaskulární nebo cerebrovaskulární komorbidity a špatně kontrolovaná hypertenze.
Po vstupním hodnocení (T0) absolvovali pacienti kontrolní návštěvy po třech (M3) a šesti (M6) měsících léčby. V T0 pacienti podstoupili neurologické vyšetření a byli instruováni k vyplňování deníku bolestí hlavy (dny s bolestí hlavy v měsíci [monthly headache days, MHD] a MMD, užívání akutní medikace, intenzita bolesti). Bolesti hlavy z nadužívání medikace (medication overuse headache, MOH) byly diagnostikovány dle kritérií ICHD‑3 [17]. Pacienti s koexistující MOH byli edukováni ve smyslu redukce nadměrného příjmu analgetik. Jakákoliv doprovodná profylaktická léčba pokračovala beze změn. Klinické proměnné – MMD, MHD, měsíční počet dní s akutní medikací (acute medication days, AMD) a množství akutní medikace (acute medication pills, AMP) – byly zaznamenány v T0, M3 a M6 pomocí deníku bolestí hlavy a polostrukturovaného klinického rozhovoru. Pro každou klinickou proměnnou byl zachycen průměr za poslední tři měsíce předcházející hodnocení. V každém časovém bodě byla kvantifikována intenzita migrénózní bolesti pomocí numerické hodnoticí škály (Numeric Rating Scale, NRS) [18], postižení související s migrénou bylo hodnoceno pomocí dotazníku MIDAS [19] a dopady migrény pomocí šestipoložkového testu (Headache Impact Test‑6, HIT‑6) [20]. Na základě skóre NRS, MIDAS a HIT‑6 byli pacienti rozděleni do různých skupin, které reflektovaly růst úrovně bolestí hlavy a jejich intenzitu i vliv na nemocné [18–20]. Výskyt nežádoucích účinků byl vyhodnocován v rámci každé návštěvy.
Primárním cílovým ukazatelem účinnosti byl rozdíl mezi skupinami při redukci počtu MMD a MHD v časovém období T0–M3 a T0–M6. Primárním cílovým ukazatelem bezpečnosti byl rozdíl ve výskytu nežádoucích účinků mezi skupinami. Sekundární cílové ukazatele zahrnovaly: rozdíly v míře odpovědi (response rate, RR) ≥ 30 %, ≥ 50 % a ≥ 75 % v M3 a M6 (RR byla definována snížením počtu MMD v období T0–M3 a T0–M6); rozdíly v redukci příjmu akutní medikace a při řešení MOH v období T0–M3 a T0–M6; rozdíly ve zlepšení skóre NRS, HIT‑6 a MIDAS v období T0–M3 a T0–M6; rozdíly ve ≥ 50% RR ve smyslu snížení skóre MIDAS v období T0–M3 a T0–M6. Tento poslední sekundární cílový ukazatel byl definován na základě kritérií italské lékové agentury, jež při ≥ 50% snížení ve skóre MIDAS po třech a poté po šesti měsících léčby stanovují povinnost pokračovat v terapii.
Výsledky
Klinické charakteristiky
Čtyřicet devět pacientů absolvovalo měsíční režim (MR) podávání fremanezumabu a 46 pacientů režim čtvrtletní (QR). Všichni pacienti dokončili tříměsíční léčebné období; 79 pacientů dokončilo šestiměsíční léčebné období (43 MR a 36 QR). Tři pacienti ze skupiny MR a sedm pacientů ze skupiny QR bylo ztraceno v průběhu sledování, tři pacienti MR a tři pacienti QR ukončili léčbu po třech měsících z důvodu neúčinnosti. Demografické a klinické charakteristiky byly na počátku sledování podobné mezi oběma skupinami. Skupina MR zahrnula 36 (73 %) žen a skupina QR 37 (80 %) žen (p = 1,0); medián věku byl 55, resp. 51 let (p = 0,5). Dvacet šest (53 %) pacientů ve skupině MR a 28 (61 %) pacientů ve skupině QR mělo chronickou migrénu (p = 1,0). Pacientů s MOH bylo 26 (53 %), resp. 26 (57 %), p = 1,0; čtyři (8 %), resp. šest (13 %) pacientů mělo migrénu s aurou (p = 1,0). Pacientů užívajících souběžnou profylaxi, včetně antidepresiv, betablokátorů a antiepileptik, bylo 22 (45 %) ve skupině MR a 13 (28 %) ve skupině QR (p = 0,8). Pacientů s komorbiditami bylo 14 (29 %), resp. 17 (37 %), p = 1,0. Ke komorbiditám patřily hypertenze, dystyreóza a úzkostná nebo depresivní porucha. Medián trvání onemocnění činil 36, resp. 30 let (p = 1,0); medián selhání předchozí preventivní medikace byl čtyři, resp. tři (p = 1,0) [1].
Snížení frekvence migrény a bolestí hlavy
Po třech i po šesti měsících léčby fremanezumabem došlo u pacientů s měsíčním i čtvrtletním režimem k významné redukci počtu MHD a MMD. V případě M3 byla střední redukce MHD –9 pro měsíční režim a –7 pro čtvrtletní režim, zatímco u M6 to bylo –10, resp. –8. Byl pozorován trend ve prospěch měsíčního režimu v případě M3 (p = 0,04), avšak nikoliv v případě M6 (p = 0,07). V případě M3 byla střední redukce počtu MMD –8 pro měsíční režim a –7 pro čtvrtletní režim, zatímco v případě M6 byla doložena redukce počtu MMD –10, resp. –8. Zjištěna byla mírná výhoda pro měsíční režim oproti čtvrtletnímu v případě M3 (p = 0,03), ale nikoliv v případě M6 (p = 0,2) [1].
Bezpečnost
Nežádoucí účinky byly hlášeny jedním pacientem ve skupině s měsíčním režimem a dvěma pacienty ve skupině s čtvrtletním režimem v případě M3 a po jednom pacientovi v obou skupinách v případě M6. Nejčastějším nežádoucím účinkem byla přechodná reakce v místě vpichu (hlášeno dvěma pacienty ve skupině QR v M3 a jedním pacientem ve skupině MR v M6). Zácpu uvedl jeden pacient ve skupině s měsíčním režimem v M3 a jeden pacient ve skupině s čtvrtletním režimem v M6. Všechny nežádoucí reakce byly mírné a žádná nevyžadovala další ošetření nebo procedury. Nebyl zjištěn statisticky významný rozdíl ve frekvenci nežádoucích účinků mezi dvěma režimy v případě M3 (p = 0,6) nebo M6 (p = 1,0) [1].
Míra odpovědi
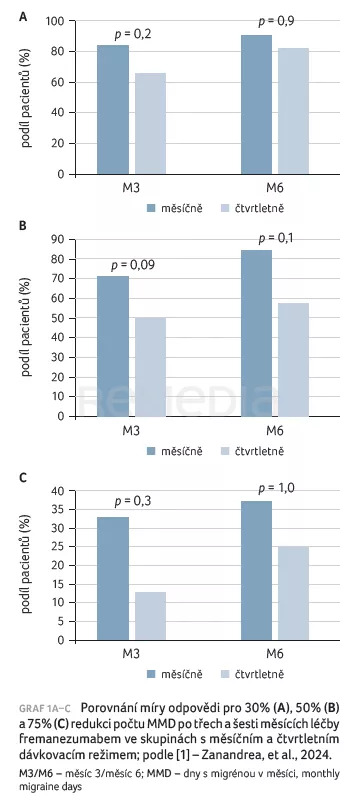
Graf 1A–C znázorňuje rozložení míry odpovědi u 30%, 50% a 75% redukce počtu MMD ve dvou léčebných skupinách v různých časových bodech. V případě M3 bylo ≥ 30% snížení počtu MMD pozorováno u 41 (84 %) pacientů ve skupině s měsíčním režimem a u 30 (65 %) pacientů ve skupině se čtvrtletním režimem, bez statisticky významného rozdílu mezi oběma skupinami (p = 0,2). Snížení o ≥ 50 % bylo pozorováno u 35 (71 %) pacientů ve skupině s měsíčním režimem a u 23 (50 %) pacientů ve skupině se čtvrtletním režimem, bez statisticky významného rozdílu mezi skupinami (p = 0,09); ≥ 75% redukce počtu MMD byla doložena u 16 (33 %), resp. šesti (13 %) pacientů, bez statisticky významného rozdílu mezi skupinami (p = 0,3). V případě M6 ≥ 30% snížení počtu MMD bylo potvrzeno u 39 (91 %) pacientů ve skupině s měsíčním režimem a u 29 (81 %) pacientů ve skupině se čtvrtletním režimem, redukce o ≥ 50 % u 36 (84 %), resp. 21 (58 %) pacientů, snížení o ≥ 75 % u 16 (37 %), resp. devíti (25 %) pacientů, vždy bez statisticky významného rozdílu mezi skupinami (p = 0,9, resp. p = 0,1, resp. p = 1,0) [1].
Snížení užívání akutní medikace a redukce MOH
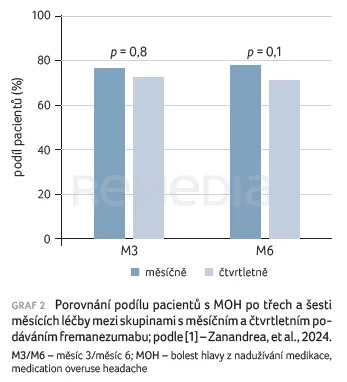
V časových bodech M3 a M6 bylo v obou skupinách zaznamenáno významné snížení AMP a AMD bez významného rozdílu mezi skupinami (AMP: M3 p = 0,3, M6 p = 1,0; AMD: M3 p = 0,09, M6 p = 0,3). V případě M3 se parametr AMP při měsíčním a čtvrtletním podání snížil o 11, resp. devět a AMD o 10, resp. sedm. V případě M6 se parametr AMP snížil o 11, resp. devět a AMD o 10, resp. osm. U pacientů s MOH bylo pozorováno ukončení nadužívání medikace u 20 (77 %) osob ve skupině s měsíčním režimem a u 19 (73 %) osob ve skupině se čtvrtletním režimem v M3; 18 (78 %) z 23 pacientů s MOH ve skupině s měsíčním režimem, která dokončila šestiměsíční období léčby, ukončilo nadužívání medikace v M6; stejný výsledek byl pozorován u 15 (71 %) z 21 pacientů ve skupině se čtvrtletním režimem. Statisticky nebyl zjištěn významný rozdíl mezi těmito dvěma režimy v M3 (p = 0,8) nebo M6 (p = 0,1; graf 2) [1].
Snížení skóre NRS, HIT‑6 a MIDAS
Po třech i po šesti měsících léčby fremanezumabem došlo u obou skupin pacientů k významnému snížení skóre NRS, HIT‑6 a MIDAS. V případě M3 skóre MIDAS pokleslo o 52 a 48 bodů, HIT‑6 o devět a sedm bodů a NRS v obou skupinách o jeden bod. V případě M6 byla zaznamenána redukce skóre MIDAS o 69 a 51 bodů, HIT‑6 o devět a 10 bodů a NRS o dva body v obou skupinách. Nebyl zjištěn statisticky významný rozdíl mezi dvěma léčebnými režimy v M3 (NRS: p = 0,8, HIT‑6: p = 1,0, MIDAS: p = 1,0) nebo v M6 (NRS: p = 1,0, HIT‑6: p = 1,0, MIDAS: p = 1,0). Padesátiprocentní nebo vyšší snížení skóre MIDAS bylo pozorováno u 44 (90 %) pacientů ve skupině s měsíčním režimem a u 41 (89 %) pacientů ve skupině se čtvrtletním režimem v M3, bez statisticky významného rozdílu mezi skupinami (p = 1,0). V M6 uvedlo stejný výsledek 39 (91 %) pacientů ve skupině s měsíčním režimem a 32 (89 %) pacientů ve skupině se čtvrtletním režimem, bez statisticky významného rozdílu mezi skupinami (p = 1,0) [1].
Diskuse
Multicentrická prospektivní studie z reálného života prokázala, že oba dávkovací režimy fremanezumabu – měsíční (225 mg) a čtvrtletní (675 mg) – jsou účinné při snižování frekvence migrenózních atak, snižování užívání akutní medikace, zmírňování závažnosti migrény a souvisejícího postižení v tzv. real‑life podmínkách [1]. Měsíční i čtvrtletní dávkovací režim fremanezumabu potvrdil klinický přínos také u pacientů s obtížně léčitelnou migrénou, u nichž selhalo až pět předchozích preventivních medikací, jak už dříve doložily RCTs [5–7]. Předchozí RCTs a studie z reálného života prokázaly účinnost fremanezumabu v prevenci migrény [5–16]. Síťová metaanalýza RCTs zaměřených na preventivní anti‑CGRP léčbu migrény potvrdila, že fremanezumab v dávce 225 mg i 675 mg je efektivní v redukci počtu MMD, MHD a AMD ve srovnání s placebem. Tyto výsledky byly doprovázeny rovněž výrazně vyšší mírou odpovědi na léčbu (≥ 50 % a ≥ 75 %) [21]. Recentní poolovaná metaanalýza RCTs nenaznačila podstatný rozdíl v průměrné změně od výchozí hodnoty v počtu MMD během 12týdenního období léčby mezi oběma dávkovacími režimy fremanezumabu, a to u pacientů s epizodickou i chronickou migrénou [11].
Primárním cílem italské studie z hlediska účinnosti bylo posoudit jakýkoliv rozdíl mezi oběma režimy ve vztahu k redukci výskytu migrenózních atak a frekvence bolestí hlavy. Autoři pozorovali mírnou výhodu měsíčního dávkovacího režimu při snižování počtu MHD a MMD v M3. Nicméně toto zjištění nebylo potvrzeno, když byla porovnána míra odpovědi na léčbu (≥ 30 %, ≥ 50 %, a ≥ 75 %) ve vztahu k redukci počtu MMD mezi skupinami s odlišným dávkovacím režimem [1]. Japonská retrospektivní real‑life studie, která zahrnula 75 pacientů léčených měsíčně podávaným fremanezumabem a 52 pacientů se čtvrtletním režimem po dobu šesti měsíců, neodhalila významné rozdíly mezi měsíčním a čtvrtletním dávkováním v redukci počtu MMD od výchozího stavu u epizodické i chronické migrény [16]. Výhoda měsíčního režimu ve srovnání se čtvrtletním zjištěná v italské studii byla omezena pouze na první čtvrtletí léčby, v M6 se významné rozdíly mezi skupinami neobjevily. Zatímco u pacientů užívajících fremanezumab měsíčně byla zaznamenána stabilní klinická odpověď od M3 do M6, při čtvrtletním dávkování se klinické výsledky v období M3–M6 zlepšovaly [1]. Koncentrace fremanezumabu se blíží ustálenému stavu přibližně za šest měsíců u obou dávkovacích režimů [22]. To může vysvětlovat pozorovanou mírnou výhodu měsíční administrace oproti čtvrtletní pouze v prvních třech měsících léčby, která již není patrná v šestém měsíci, kdy oba dávkovací režimy dosáhnou ustáleného stavu.
Podle výsledků RCTs je fremanezumab bezpečný a dobře tolerovaný, k nejběžnějším nežádoucím účinkům této léčby patří přechodné reakce v místě vpichu [5–7]. Recentní metaanalýza ukázala, že nejčastějšími nežádoucími účinky spojenými s terapií fremanezumabem byly erytém v místě vpichu, indurace a pruritus [23]. Přechodná reakce v místě vpichu představuje rovněž nejběžnější nežádoucí účinek ve studiích z reálného života [12–15]. Také italská studie potvrdila, že nejčastějším nežádoucím účinkem byly reakce v místě vpichu jak u měsíčně, tak u čtvrtletně podávaného fremanezumabu, bez výrazného rozdílu mezi oběma režimy. Studie neodhalila rozdíly mezi skupinami při redukci AMP a AMD nebo při zvládnutí MOH [1].
Závěr
Italská studie porovnává účinnost dvou dávkovacích režimů fremanezumabu v klinické praxi nejen z hlediska snížení frekvence migrén, ale i z hlediska omezení užívání akutní medikace, zmírnění závažnosti migrény a souvisejících postižení. Real‑life studie poskytuje důkazy o účinnosti měsíčního i čtvrtletního podávání fremanezumabu po dobu tří a šesti měsíců léčby v reálných podmínkách.
Literatura
[1] Zanandrea L, Messina R, Cetta I, et al. Effectiveness and safety of monthly versus quarterly fremanezumab for migraine prevention: An Italian, multicenter, real‑life study. Eur J Neurol 2024; 00: e16410.
[2] Steiner TJ, Stovner LJ. Global epidemiology of migraine and its implications for public health and health policy. Nat Rev Neurol 2023; 19: 109–117.
[3] Edvinsson L, Haanes KA, Warfvinge K, Krause DN. CGRP as the target of new migraine therapies‑successful translation from bench to clinic. Nat Rev Neurol 2018; 14: 338–350.
[4] Sacco S, Bendtsen L, Ashina M, et al. European Headache Federation guideline on the use of monoclonal antibodies acting on the calcitonin gene related peptide or its receptor for migraine prevention. J Headache Pain 2019; 20: 6.
[5] Dodick DW, Silberstein SD, Bigal ME, et al. Effect of fremanezumab compared with placebo for prevention of episodic migraine: a randomized clinical trial. JAMA 2018; 319: 1999–2008.
[6] Silberstein SD, Dodick DW, Bigal ME, et al. Fremanezumab for the preventive treatment of chronic migraine. N Engl J Med 2017; 377: 2113–2122.
[7] Ferrari MD, Diener HC, Ning X, et al. Fremanezumab versus placebo for migraine prevention in patients with documented failure to up to four migraine preventive medication classes (FOCUS): a randomised, double‑blind, placebo‑controlled, phase 3b trial. Lancet Lond Engl 2019; 394: 1030–1040.
[8] Ashina M, Cohen JM, Gandhi SK, du E. Reduction in the severity and duration of headache following fremanezumab treatment in patients with episodic and chronic migraine. Headache 2021; 61: 916–926.
[9] Silberstein SD, Cohen JM, Seminerio MJ, et al. The impact of fremanezumab on medication overuse in patients with chronic migraine: subgroup analysis of the HALO CM study. J Headache Pain 2020; 21: 114.
[10] Fiedler‑Kelly J, Passarell J, Ludwig E, et al. Effect of fremanezumab monthly and quarterly doses on efficacy responses. Headache 2020; 60: 1376–1391.
[11] Barash S, Ramirez Campos V, Ning X, et al. Comment on: Gao B, Lu Q, Wan R, et al. Monthly versus quarterly fremanezumab for the prevention of migraine: a systemic review and meta‑analysis from randomized controlled trials. Naunyn Schmiedebergs Arch Pharmacol 2021; 394: 2343–2346.
[12] Driessen MT, Cohen JM, Patterson‑Lomba O, et al. Real‑world effectiveness of fremanezumab in migraine patients initiating treatment in the United States: results from a retrospective chart study. J Headache Pain 2022; 23: 47.
[13] Argyriou AA, Dermitzakis EV, Xiromerisiou G, et al. Efficacy and safety of fremanezumab for migraine prophylaxis in patients with at least three previous preventive failures: prospective, multicenter, real‑world data from a Greek registry. Eur J Neurol 2023; 30: 1435–1442.
[14] Barbanti P, Egeo G, Aurilia C, et al. Fremanezumab in the prevention of high‑frequency episodic and chronic migraine: a 12‑week, multicenter, real‑life, cohort study (the FRIEND study). J Headache Pain 2022; 23: 46.
[15] Barbanti P, Egeo G, Aurilia C, et al. Early and sustained efficacy of fremanezumab over 24‑weeks in migraine patients with multiple preventive treatment failures: the multicenter, prospective, real‑life FRIEND2 study. J Headache Pain 2023; 24: 30.
[16] Suzuki S, Suzuki K, Shiina T, et al. Real‑world experience with monthly and quarterly dosing of fremanezumab for the treatment of patients with migraine in Japan. Front Neurol 2023; 14: 1220285.
[17] Headache Classification Committee of the International Headache Society (IHS). The International Classification of Headache Disorders. Cephalalgia 2018; 38: 1–211.
[18] Aicher B, Peil H, Peil B, Diener HC. Pain measurement: Visual Analogue Scale (VAS) and Verbal Rating Scale (VRS) in clinical trials with OTC analgesics in headache. Cephalalgia 2012; 32: 185–197.
[19] Stewart WF, Lipton RB, Dowson AJ, Sawyer J. Development and testing of the Migraine Disability Assessment (MIDAS) Questionnaire to assess headache‑related disability. Neurology 2001; 56(6Suppl 1): S20–S28.
[20] Kosinski M, Bayliss MS, Bjorner JB, et al. A six‑item short‑form survey for measuring headache impact: the HIT‑6. Qual Life Res 2003; 12: 963–974.
[21] Haghdoost F, Puledda F, Garcia‑Azorin D, et al. Evaluating the efficacy of CGRP mAbs and gepants for the preventive treatment of migraine: a systematic review and network meta‑analysis of phase 3 randomised controlled trials. Cephalalgia 2023; 43: 3331024231159366.
[22] Fiedler‑Kelly JB, Cohen‑Barak O, Morris DN, et al. Population pharmacokinetic modelling and simulation of fremanezumab in healthy subjects and patients with migraine. Br J Clin Pharmacol 2019; 85: 2721–2733.
[23] Messina R, Huessler EM, Puledda F, et al. Safety and tolerability of monoclonal antibodies targeting the CGRP pathway and gepants in migraine prevention: a systematic review and network meta‑analysis. Cephalalgia 2023; 43: 3331024231152169.
Redakčně zpracovala PhDr. Nikola Homolová Richtrová. Účinnost a bezpečnost fremanezumabu podávaného měsíčně versus čtvrtletně ve studii z reálného života. Remedia 2025; 35, číslo 1/2025
Komentář ke studii z reálného života srovnávající účinnost a bezpečnost fremanezumabu podávaného měsíčně versus čtvrtletně
Cílem italské prospektivní multicentrické studie (Zanandrea a kol., 2024) bylo porovnat účinnost a bezpečnost měsíčně a čtvrtletně podávaného fremanezumabu v tzv. real‑life podmínkách [1].
Randomizované klinické studie (HALO; FOCUS, na které jsme se také podíleli) již prokázaly, že nejsou žádné významné rozdíly ve snížení frekvence dnů s migrénou za měsíc (monthly migraine days, MMD) mezi měsíčně a čtvrtletně podávaným fremanezumabem. Toto potvrdily i studie z reálné praxe (např. FRIEND nebo PEARL) z hlediska bezpečnosti i snášenlivosti u epizodické (EM) i chronické migrény (CM) u pacientů po selhání předchozí konvenční profylaktické terapie i s různými komorbiditami. Nevýhodou uvedených studií však bylo, že většina pacientů byla léčena měsíčně a kvartálně jen malá část.
Multicentrická prospektivní studie z reálného života zahrnula tři italská centra pro léčbu bolestí hlavy, zařazeno bylo celkem 95 pacientů s migrénou, po selhání tří předchozích medikací [1]. Po třech měsících byly hodnoceny počet MMD, užívání akutní medikace, bolest hlavy z nadužívání medikace (medication overuse headache, MOH), skóre dotazníků MIDAS (Migraine Disability Assessment), HIT‑6 (Headache Impact Test‑6) a NRS (Numeric Rating Scale) a nežádoucí účinky. Rozdělení pacientů bylo srovnatelné: 49 s měsíčním podáním (MR), 46 se čtvrtletním/kvartálním podáním (QR); studii dokončilo 43 MR a 36 QR. Někteří pacienti užívali souběžnou perorální profylaxi (45 %! versus 28 %). Nejčastější komorbidity byly typické – arteriální hypertenze, dysfunkce štítné žlázy a psychické poruchy.
V případě kontrolní návštěvy za tři měsíce (M3) byla střední redukce počtu MMD –8 pro měsíční režim a –7 pro čtvrtletní režim, zatímco v případě kontrolní návštěvy za šest měsíců (M6) byla doložena redukce počtu MMD –10, resp. –8. Zjištěna byla mírná výhoda pro měsíční režim oproti čtvrtletnímu v případě M3 (p = 0,03), ale nikoliv v případě M6.
Nejčastějšími nežádoucími účinky byly přechodná reakce v místě vpichu (1 u MR a 2 u QR) a obstipace (1 u MR a 1 u QR). Všechny nežádoucí reakce byly mírné a žádná nevyžadovala další ošetření nebo procedury. Snížení užití akutní medikace a MOH bylo obdobné, stejně jako snížení hodnot ve výše uvedených dotaznících.
Z uvedené studie vychází obdobný efekt měsíčního a čtvrtletního podání fremanezumabu. Výhodou měsíčního podání byla pouze mírně vyšší redukce počtu MMD ve třetím měsíci, což bylo hodnoceno jako rychlejší a vyšší akumulace léčiva celkově, nejen mezi druhým a třetím měsícem. Nicméně toto se v šestém měsíci vyrovnává. V diskusi není uveden možný vliv trvající konvenční profylaxe, která byla četnější u MR. Počet pacientů byl na časové období čtyř let relativně malý a volba léčebného schématu byla nerandomizovaná, tedy lékař ji volil podle svého pohledu na jednotlivý případ a lze předpokládat, že i podle volby pacienta.
Na konci bych připojil v komentáři svou osobní zkušenost s MR a QR podáváním fremanezumabu. Po zkušenosti s bezpečností podávání v randomizované klinické studii a následném programu podávání léčiva před schválením úhrady nasazuji fremanezumab pouze kvartálně, pakliže si pacient nepřeje podávání měsíční. U malého množství pacientů jsme přešli z QR na MR, zejména když byl počet MMD relativně vyšší v posledním měsíci, ale u přibližně poloviny nemocných jsme se vrátili zpět ke QR pro obdobný efekt. Podíl pacientů s redukcí počtu MMD 75–100 % je při QR podání významný. V závěru italské studie je uvedeno, že k ověření výsledků jsou nutné další studie z reálného života s větším počtem pacientů. V českém registru pacientů s migrénou léčených biologickou léčbou (ReMig) je nyní kolem 1 200 nemocných léčených fremanezumabem. Zde by bylo možné efekt MR a QR také srovnat, ale poměr pacientů léčených MR bude, jak je stále běžné, o mnoho vyšší než léčených QR.
MUDr. Tomáš Nežádal, Ph.D.
Neurologické oddělení
Ústřední vojenská nemocnice – Vojenská fakultní nemocnice
U Vojenské nemocnice 1200/1, 169 02 Praha 6
e‑mail: nezadal@gmail.com
Literatura
[1] Zanandrea L, Messina R, Cetta I, et al. Effectiveness and safety of monthly versus quarterly fremanezumab for migraine prevention: An Italian, multicenter, real‑life study. Eur J Neurol 2024; 00: e16410.

